结合氢键的原子的电负性越强,氢键越强。
元素的电负性越大,表示其原子在化合物中吸引电子的能力越强。又称为相对电负性,简称电负性,也叫电负蔽搜度。电负性综合考虑了电离能和电子亲合能。
氢键通常可用X-H…Y来表示。其中X以共价键(或离子键)与氢相连,具有较高的电负性,可以稳定负电荷,因此氢易解离,具有酸性(质子给予体)。而Y则具有较高的电子密度,一般是含有孤对电子的原子,容易吸引氢质子,从而与X和H原子形成三中心四电子键。
扩展资料:
氢键的分类:
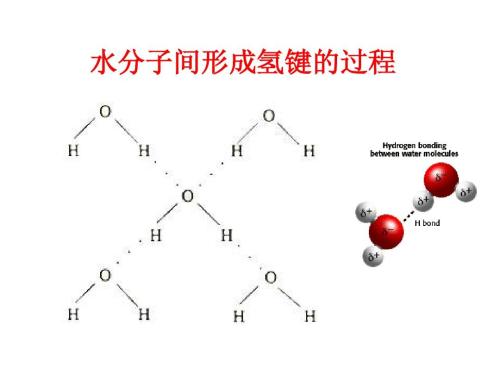
1、同种分子之间
现以HF为例说明氢键的形成。在HF分子中,由于F的电负掘并宽性(4.0)很大,共用电子对强烈偏向F原子一边,而H原子核外只有一个电子,其电子云向F原子偏移的结果,使得它几乎要呈质子状态。
2、不同种分子之间
不仅同种分子之间可以存在氢键,某些不同种分子之间也可能形成氢键。所以这就导致了氨气在水中的惊人溶解度:1体积水中可溶解700体积氨气。
3、分子内氢键
某些分子内,例如HNO₃、邻硝基苯酚分子可以形成分子内氢键,还有一个苯环上连有两个羟基,一个羟基中的氢与另一个羟基中的氧形成氢键。分子内氢键由于受环状结构的限制,X-H…Y往往不能在同一直线上。分子内氢键使物质熔沸点降低。
参考资料来源: